
Как модели ИИ переосмысливают обнаружение опухоли на уровне ткани
18 июля 2025 г.Таблица ссылок
Аннотация и I. Введение
Материалы и методы
2.1. Несколько экземпляров обучения
2.2. Модель архитектуры
Результаты
3.1. Методы обучения
3.2. Наборы данных
3.3. WSI предварительно обработайте трубопровод
3.4. Результаты классификации и обнаружения ROI
Дискуссия
4.1. Задача обнаружения опухоли
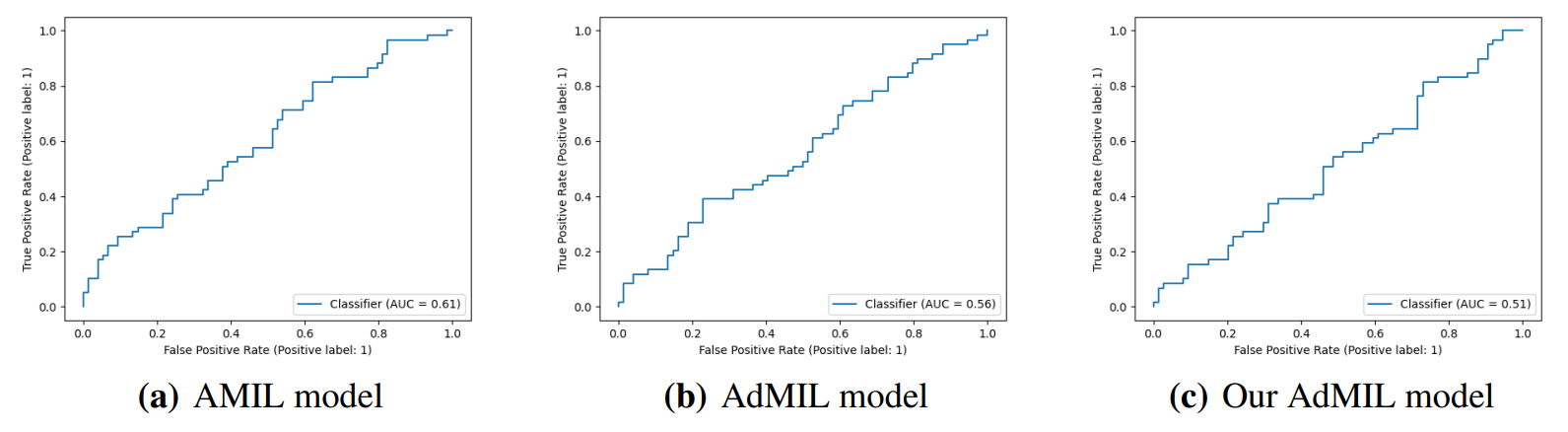
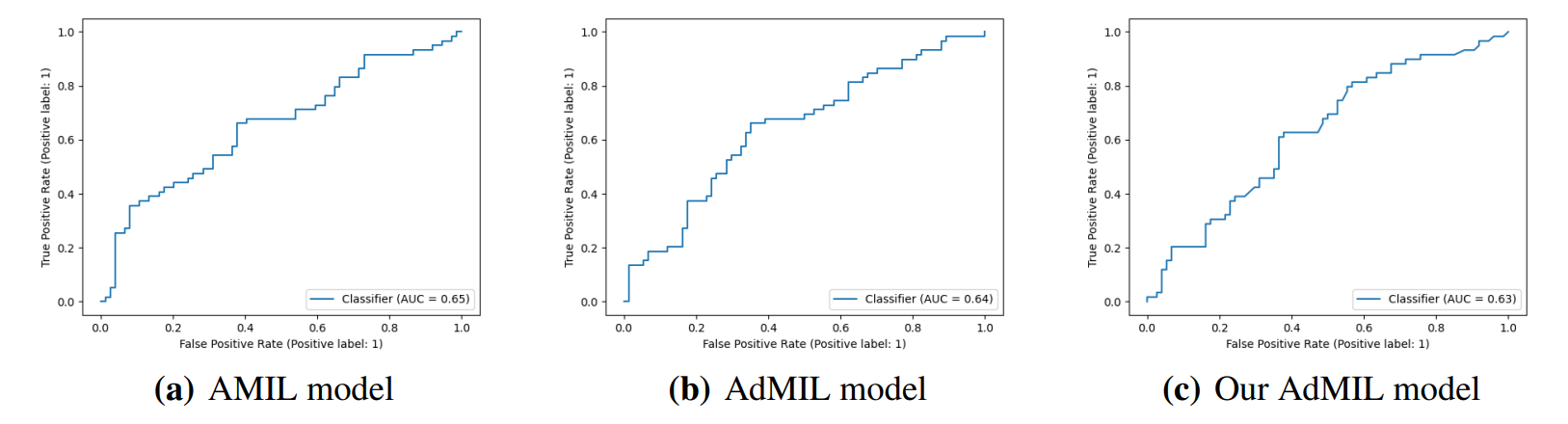
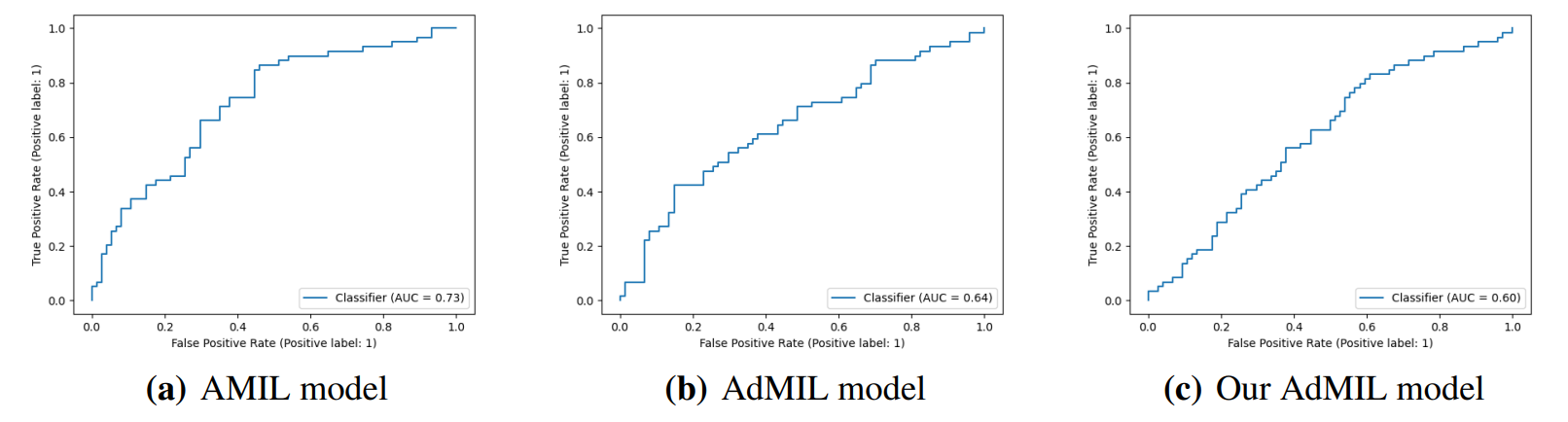
4.2. Задача обнаружения мутаций генов
Выводы
Благодарности
Авторская декларация и ссылки
4. Обсуждение
4.1. Задача обнаружения опухоли
Модели, выполняемые наравне с современным искусством для этой задачи, с точки зрения их способности правильно классифицировать WSI с значениями AUC выше 0,9 (таблица 1). В оригинальной статье [7] использовались два набора данных изображений H & E: набор данных рака молочной железы и набор данных рака толстой кишки. Сравнивая наши результаты с показанными в этой работе, мы получили значительно лучшие результаты, чем первые и аналогичные результаты со вторым. Однако следует отметить, что эти наборы данных не только
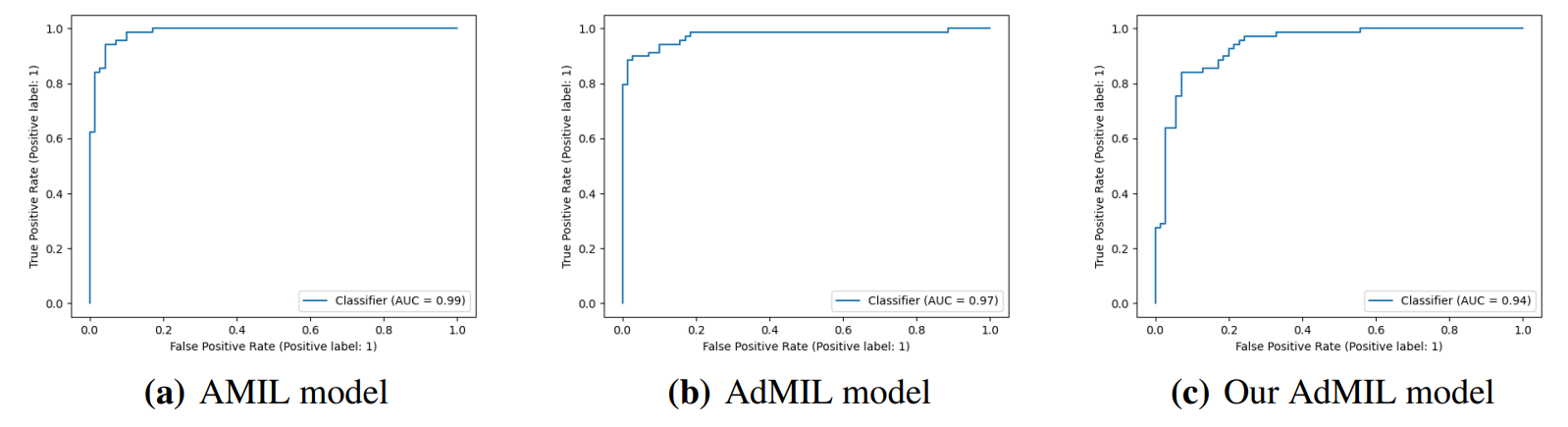

от другого типа рака, но также состоит из пятен в виде мешков, а не слайдов. Другие работы использовали архитектуру Amil и собственные вариации с наборами данных, состоящими из плиток при более высоких увеличениях [11, 20]. В целом, мы получили лучшую AUC, чем предыдущая работа, которая подтверждает тот факт, что увеличение в 5 раз может быть адекватным для выявления опухолей.
Учитывая, что набор данных, который мы использовали, имели только слайды флэш-морозен, что он представлял некоторые артефакты, и что он включал различные проценты опухолей, мы можем предположить, что модели научились отличать не связанные с факторы от опухолей, присутствующих на изображениях. Более того, эти результаты были получены из плиток при увеличении 5 -кратного увеличения, уровня, который отображает ткани, но не клетки. Это подтверждает гипотезу о том, что, как и патологи, модели могут научиться идентифицировать слайды опухолей на уровне ткани. Это также показывает, что сама по себе задача может быть недостаточно сложной задачей, и изучение более высоких увеличений не значительно улучшит способность классификации слайдов. Это было связано с этими результатами и тем фактом, что это наиболее распространенный уровень, используемый для обнаружения опухоли патологами, мы не изучали дальнейшие уровни увеличения для этой задачи.
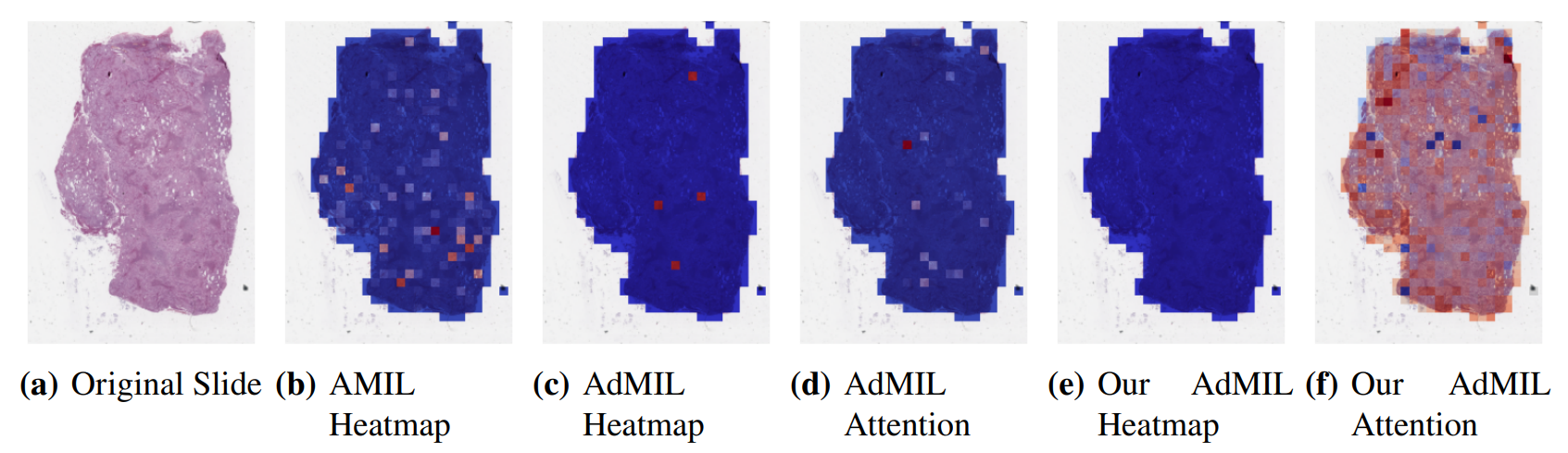
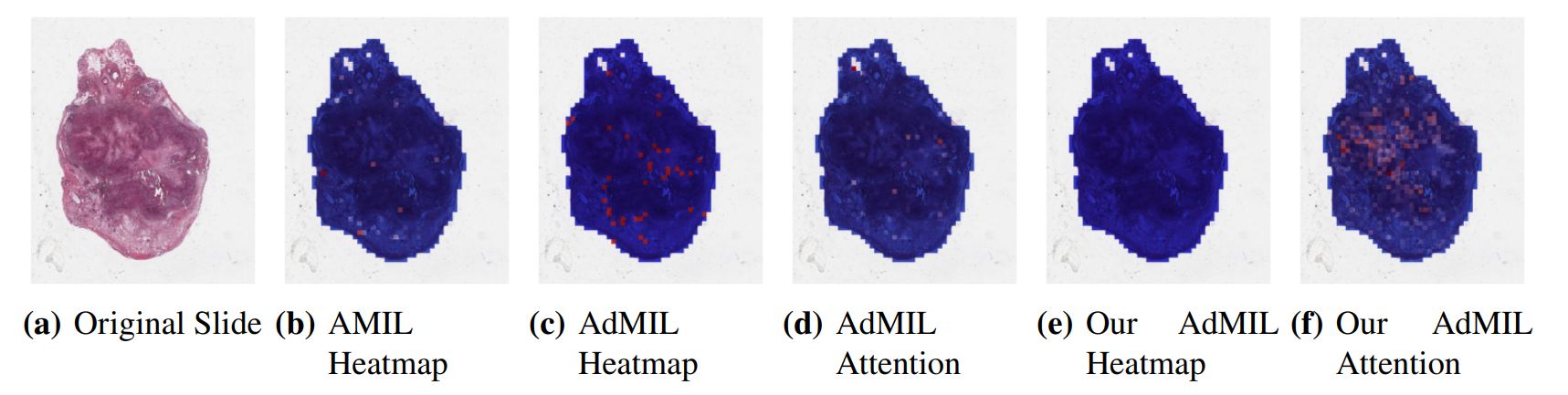
Анализируя полученные оценки внимания, мы наблюдали, что как архитектура AMIL (рис. Такое поведение может быть особенно важным, если области опухоли (или желаемые ROI) кажутся более разбросанными. С другой стороны, для морфологий, которые обычно более сфокусированы на конкретном патче, слой внимания от исходного Admil может быть предпочтительным.
С другой стороны, при анализе возбуждающих/ингибирующих баллов, полученных в рамках аддитивного MIL, оценки, полученные оригинальной моделью Admil, как правило, являются положительными для большинства пятен (рис. Такое поведение наблюдалось для большинства слайдов. Поскольку единственной разницей в архитектуре моделей является их слои внимания, мы заключаем, что более редкие оценки внимания, как правило, заставляют классификатор экземпляра рассматривать только небольшое подмножество пятен как возбуждающие. В зависимости от результатов, полученных в результате будущей оценки актуальности тепловых карт, это может подтвердить гипотезу о том, что оценки внимания не обязательно подчеркивают желаемые рентабельность и могут быть недостаточно для значимой живописи WSI.
Также интересно заметить, что оценки внимания AMIL, как правило, больше фокусируются на краях ткани (рис. 7 (б)). Это может означать, что опухоль присутствует в границах ткани, но она может также выявить некоторую смещение в модели для участков, которые включают некоторый процент фона. Из-за используемого увеличения и переломов, которые появляются на слайдах флеш-замороженных, было значительное количество пятен, которые содержали фон, по сравнению с более высокими увеличениями, и возможно, что это обусловлено способностью к обучению модели.
Дальнейшая оценка обнаружения ROI должна быть проведена, особенно качественная оценка полученных тепловых карт. Нам понадобится помощь патологов, чтобы подтвердить, что оценки патчей, которые получают эти модели, являются показателями областей опухоли. Кроме того, в то время как модель AMIL показала немного лучшего AUC, чем другие модели, это не обязательно означает, что ее тепловые карты более актуальны или полезны для патологов. Оценки патчей, полученные из двух других моделей, из -за их ингибирующей/возбуждающей природы, могут дать большее понимание присутствия опухоли на слайдах. Из-за ограничений по времени и несуществующих тепловых карт наземной истины эта оценка остается в будущей работе.
Авторы:
(1) Мармим Афонсо, институт Superior Técnico, Universidade de Lisboa, Av. Ровиско Паис, Лиссабон, 1049-001, Португалия;
(2) Praphulla M.S. Bhawsar, Отдел эпидемиологии и генетики рака, Национальный институт рака, Национальный институт здравоохранения, Bethesda, 20850, штат Мэриленд, США;
(3) Monjoy Saha, Отделение эпидемиологии и генетики рака, Национальный институт рака, Национальный институт здравоохранения, Bethesda, 20850, штат Мэриленд, США;
(4) Джонас С. Алмейда, Отделение эпидемиологии и генетики рака, Национальный институт рака, Национальный институт здравоохранения, Бетесда, 20850, штат Мэриленд, США;
(5) Арлиндо Л. Оливейра, Институт Верхний Течнико, Университет де Лисбоа, ав. Rovisco Pais, Лиссабон, 1049-001, Португалия и INESC-ID, R. Alves Redol 9, Lisbon, 1000-029, Португалия.
Эта статья есть
Оригинал
Recent Post
-
Bitpanda запускает Defi Wallet для Power Europe в будущее Onchain
20 августа 2025 г. -
Как Toyota Blockchain Lab хочет сделать автомобили готовыми к финансированию: Внутри предложения Toyota's Mon предложение
20 августа 2025 г. -
Получение звонков клиентов по бюджету в размере 0 долларов США: уроки от стартапа репетиторства
20 августа 2025 г. -
За кулисами эксперимента парного программирования
19 августа 2025 г. -
Простое руководство по измерению времени и труда в программировании
19 августа 2025 г.
Categories
- Python
- blockchain
- web
- hackernoon
- вычисления
- вычислительные компоненты
- цифровой дом
- игры
- аудио
- домашний кинотеатр
- Интернет
- Мобильные вычисления
- сеть
- фотосъемка видео
- портативные устройства
- программного обеспечения
- телефон и связь
- телевидение
- видео
- мир технологий
- умные гиды
- облако
- искусственный интеллект
- се
- Samsung
- умные города
- digitaltrends
- отели
- Startups
- Venture
- Crypto
- Apps
- безопасность
- техника и работа
- cxo
- мобильность
- разработчик
- 5г
- майкрософт
- инновации
- Права и свободы
- Законодательство и право
- Политика и общество
- Космическая промышленность
- Информационные технологии
- Технологии
- Образование
- Научные исследования
- Автомобильная промышленность
- Программная инженерия
- IT и технологии
- Веб-разработка
- Программирование
- Автоматизация
- Карьерный рост
- Программирование и анализ данных
- Трудоустройство
- Политика
- Искусственный интеллект
- ИТ-технологии
- Программное обеспечение
- Экологическая политика
- Образование и рынок труда
- Политика и право
- Microsoft Teams и SharePoint
- Информационная безопасность
- Кибербезопасность
- Налоги
- Образование и карьера
- Интернет и технологии
- Технологии, Государственные услуги
- Политика и технологии
- Разработка программного обеспечения
- Разработка ПО
- Машинное обучение
- Налогообложение, технологии, открытый исходный код
- Финансы и налоги
- Технологии, Интернет, Экология
- Интернет, безопасность
- Технологии и политика
- Операционные системы
- Профессиональная разработка
- Технологии, Безопасность
- Интернет и общество
- Финансовая индустрия
- Налоговый учёт
- Общественное здравоохранение
- Технологическая отрасль
- Юриспруденция
- Технологии и государство
- Здоровье и фитнес
- IT-инфраструктура
- Технологии и ИИ
- Здравоохранение
- IT
- Технологии, Экономика
- Музыка и технологии
- Здоровье и питание
- IT и безопасность
- Бизнес и предпринимательство
- Технологии, Программное обеспечение
- Технологии и инновации
- Технологии, данные, этика
- Технологии и Интернет
- Технологии и SaaS
- Медицина и здравоохранение
- Онлайн-видеосервисы
- Финансы и технологии
- Чтение и саморазвитие
- Экономика и бизнес
- Безопасность данных
- Удаленная работа
- Авиация и технологии
- Технологии, Игры
- Энергетика
- Социальные сети, безопасность, технологии
- Саморазвитие
- Безопасность информации
- Бизнес и карьера
- Технологии и отношения
- Игровая индустрия
- Компьютерная индустрия
- Математика, Искусственный интеллект
- Наука и технологии
- Технологии и безопасность
- Технологии, Удаленная работа, Бизнес
- Видеоигры
- Технологии, Искусственный интеллект, Этика
- Технологии, социальные сети, 6G
- Технологии, Программирование, AI, Разработка ПО
- Программирование, Разработка ПО, Технологии
- Животные
- Технологии, Искусственный интеллект
- Программирование, карьера, технологии, обучение
- Бизнес и технологии
- Технологии, Безопасность данных
- Астрономия и физика
- Продуктивность, личное развитие
- Медиа и Технологии
- Программирование и Искусственный Интеллект
- Социальные сети
- Политика и экономика
- Технологии, Медицина, Искусственный интеллект
- Технологии и управление
- Космос и астрономия
- Общество и политика
- Космические исследования
- Веб-дизайн
- Искусственный интеллект и безопасность данных
- Технологии, Безопасность, Конфиденциальность
- Экологическая проблема
- Технологии, Погода
- Авиация
- Транспортная сфера
- Технологии и бизнес
- Игровая промышленность
- Телевидение и реклама
- Аналитика данных
- Технологии и кибербезопасность
- Маркетинг
- Технологии и гаджеты
- Технологии, Авиация, Инновации
- Финансы и инвестиции
- Технологии и общество
- Рыночный анализ
- Космология
- Данные и бизнес
- IT и программирование
- Технологии и право
- Программирование и разработка
- Астрофизика
- Медицинские технологии
- Авиационная промышленность
- Технологии и искусственный интеллект
- Генетическая инженерия
- Бизнес и инвестиции
- Компьютерная промышленность
- Психология и социология
- Образование и технологии
- Рынок труда
- Технологии, Стартапы
- Технологии, Приватность, Чтение
- Маркетинг и продажи
- Виртуальная реальность
- Технологии, Смартфоны, Маркетинг
- Технологии, Бизнес, Личностный рост
- Экологические проблемы
- Экономика и технологии
- IT и карьера
- Интернет и безопасность
- Разработка и технологии
- Биотехнологии
- Интернет-магазины, кибербезопасность
- Финансы
- Безопасность и технологии
- Экономика
- Защита данных
- Data Science
- Карьера и работа
- Финансовый успех, мошенничество, маркетинг
- Безопасность
- Экология
- Космическая индустрия
- Программирование, Python, Обучение
- Технологии искусственного интеллекта
- Технологии, Дизайн, iOS
- Программирование, DevOps, Kubernetes
- Социальные сети и пропаганда
- Корпоративная этика
- Управление IT-инфраструктурой
- Здоровье и медицина
- Медицина
- Медицинская промышленность
- Разработка и дизайн
- Искусственный интеллект, Диагностика систем
- Образование и психология
- Технологии, Автомобильная промышленность
- Автомобили и путешествия
- Астрономия и космология
- Программирование и технологии
- IT, работа в офисе, эмоциональный интеллект
- Компьютерная техника
- Здоровье и благополучие
- Управление персоналом
- Политика и управление
- Бизнес и экономика
- Социальные сети, Пропаганда, Информационная безопасность
- Технологии и автоматизация
- Геймдизайн
- Экология и технологии
- CRM-системы, IT-инфраструктура
- Права человека
- Цифровая цензура, свобода слова, технологии
- Технологии, Искусственный интеллект, Работа
- Наука о данных
- Астрономия, Наука
- Интернет и цифровые технологии
- Технологии, управление
- Интернет и связь
- Технологии и конфиденциальность
- Интернет и свобода слова
- Психология и социальные науки
- Книги и литература
- Работа и карьера
- Финансовые технологии
- Психология и саморазвитие
- IT, программирование, сети
- Технологии, Видеоигры
- Экология и энергетика
- Космонавтика
- Медицина и технологии
- Игры и развлечения
- Музыкальная индустрия
- Логистика и складирование
- Бизнес и финансы
- Экология и окружающая среда
- Правозащита
- Социальные сети и дезинформация
- Технологии и рынок труда
- Технологии, Искусственный интеллект, Рынок труда
- Технологии и будущее
- Медицина и здоровье
- Социальные медиа
- Экология, политика, общество
- Экономика и Финансы
- Разработка игр
- Пропаганда и дезинформация
- Медицинские исследования
- Онлайн-знакомства
- Политика и СМИ
- Энергетика и электромобили
- Климатические изменения
- Технологии, Рынок труда
- IT и управление данными
- Безопасность и кибербезопасность
- Интернет-технологии
- Психология и личностное развитие
- Технологии, Мессенджеры
- Цифровые технологии
- Здоровье и самосовершенствование
- Технологии и AI
- Технологии и спорт
- IT, Разработка программного обеспечения
- Экология и климат
- Космос и технологии
- Юридическая сфера
- Безопасность в интернете
- Программирование, Искусственный Интеллект, Качество ПО
- Технологии и мессенджеры
- Социальная справедливость
- Технологическая индустрия
- Личностное развитие, Time-менеджмент, Психология
- Бизнес и менеджмент
- Технологии, Микросхемы, Автономные системы
- Фриланс и предпринимательство
- Социальные сети и искусственный интеллект
- Криминальные дела
- Социальные сети, Маркетинг
- Энергетика и экология
- Технологии, Искусственный Интеллект, Полиция
- Программирование, Искусственный интеллект, Рынок труда
- Социальные сети, дезинформация, анализ данных
- Потребительские права
- Образование и наука
- Технологии и правосудие
- Технологии, Безопасность, Автомобили
- Энергетика и окружающая среда
- Личностное развитие
- Технологии и экономика
- Медиа и коммуникации
- Миграция и иммиграция
- Личностный рост
- Налоговая система
- Медиа и телевидение
- Интернет и телекоммуникации
- Технологии, Кибербезопасность
- Здоровье
- Социальные сети и карьера
- Политика и инфраструктура
- Предпринимательство
- Промышленность программного обеспечения
- СМИ и коммуникации
- Медиа и Общество
- Медицина и генетика
- Веб-разработка и дизайн
- Технологии, процессоры
- IT-индустрия
- Кинопроизводство и технологии
- Транспорт
- Текстовый анализ
- Технологии, дизайн интерфейсов
- Офисные приложения
- Технологии, Онлайн-сервисы
- Медицина и биотехнологии
- Общество и технологии
- Экономика и рынок труда
- Искусственный интеллект, программирование, аналитика
- Технологии, следствие
- Сетевые технологии
- Технологии и веб-разработка
- Программирование, Обучение, Практика
- Коммуникации и ИТ
- Технологии, Карьера, Экономика
- Технологии и транспорт
- Здравоохранение и медицина
- Технологии, Государственное управление
- IT-безопасность
- IT и разработка
- Финансы и экономика
- Социальные сети, Общество, Сообщества
- IT-разработка
- СМИ и политика
- Конфиденциальность и безопасность
- Экономика и политика
- Технологии и общественная жизнь
- Бизнес и этика
- Безопасность и защита информации
- Технологии, бизнес
- Интернет и цензура
- Государственное регулирование
- Игры, Технологии
- Технологии и оптимизация
- Технологии ИИ и машинного обучения
- Технологии, IT, карьера
- IT и программное обеспечение
- Право и преступность
- Криминал и Правоохранительные Органы
- Технологии и энергетика
- Нефтяная промышленность
- Социальные конфликты
- Преступность и безопасность
- Таможенная очистка
- Медиа и журналистика
- Технологии и разработка приложений
- Телекоммуникации
- Консалтинг и управление
- Управление человеческими ресурсами
- Онлайн-контент
- Психология и психотерапия
- Морская отрасль
- Психология и технологии
- Социальные проблемы
- Маркетинг и реклама
- Политика и власть
- Экономика и торговля
- Карьера и развитие
- Продуктивность и Управление Временем
- Технологии, Искусственный интеллект, Реклама
- Окружающая среда
- Здоровье и технологии
- Бытовая химия
- Правовая информация
- Юстиция
- Технологии и экология
- Социальные сети и безопасность
- Базы данных
- Политика и государственное управление
- Интернет и социальные сети
- Индустрия IT
- Технологии и программное обеспечение
- История и искусственный интеллект
- Рестораны и обслуживание
- Технологии и программирование
- Социология
- Телевидение и СМИ
- Психология
- Политика и бизнес
- Мобильные устройства
- Технологии и развлечения
- Экология и охрана окружающей среды
- Маркетинг и брендинг
- Медицинская индустрия
- Кибербезопасность и технологии
- Социальные сети и политика
- Развлечения
- ИТ и автоматизация
- Криптовалюты и блокчейн
- История и идеология
- Медицина и политика
- Личная жизнь миллиардеров
- Образование и Политика
- Туризм и отдых
- Психология и искусственный интеллект
- Удаленная работа и производительность
- Выживание
- Управление командами
- Разработка
- Международная торговля
- Корпоративная ответственность
- Социальные сети и общество
- Управление серверами
- Индустрия компьютерных игр
- Политика и климат
- Онлайн-игры
- Медицинская отрасль
- Искусственный интеллект и технологии
- Религия и мораль
- Путешествия
- Социальные сети и информация
- Технологии и медиа
- Технологии и свобода
- Электронная коммерция
- Бизнес и управление
- Психическое здоровье и технологии
- Технологии и устойчивое развитие
- Технологии и социальные сети
- Профессии
- Экономика и промышленность
- Технологии и трудоустройство
- Иммиграционная политика
- Продуктивность и фокус
- Технологии и робототехника
- Свобода слова
- Психология и власть
- Социальные сети и онлайн-платформы
- Технологии и Права Человека
- СМИ и журналистика
- Окружающая среда и здоровье
- Технологии и сервисы
- Индустрия игр
- Программирование и ИИ
- Медиа и пропаганда
- Социальная сфера
- Социальные сети и общественное мнение
- Поп-культура
- Сервисы потокового вещания
- Рынок развлечений
- Социальные медиа и политика
- Технологии и информация
- Медиа и развлечения
- Квантовая криптография
- Искусственный интеллект в индустрии развлечений
- Технологии и коммуникация
- Индустрия программирования
- Финансовая безопасность
- Международные отношения
- Бизнес и лидерство
- Технологические новости и аналитика
- Программное обеспечение и технологии
- Предпринимательство и малый бизнес
- Политика и общественный контроль
- Здравоохранение и политика
- Управление персоналом и эффективность разработки
- Технологии и ИТ‑управление
- Свобода слова и дезинформация
- Веб-дизайн и разработка
- Веб‑разработка и карьера
- Культура и общество
- Цифровые права и свобода слова
- Безопасность и искусственный интеллект
- Технологии и искусство
- Мобильные приложения
- Продуктивность
- Космические технологии и безопасность
- Технологические тренды и экономика
- Безопасность и конфиденциальность
- Продуктивность и личная эффективность
- Веб‑скрейпинг и автоматизация
